Pankreaskarzinom
Klinische Einteilung
Bei den primären Pankreaskarzinomen überwiegen die Karzinome duktalen Ursprungs (70%). Von diesen sind duktale Adenokarzinome (90%, schlechte Prognose), gefolgt von neuroendokrinen Karzinomen, und nicht-duktalen Karzinome (Zystadenokarzinome und Azinuszellkarzinome). Bei den Papillen-, distalen Choledochus- und Duodenalkarzinomen handelt es sich ausschließlich um Adenokarzinome (mit allerdings besserer Prognose), und die Einteilung der UICC trennt ausdrücklich die Karzinome des exokrinen Pankreas von den vorgenannten Tumoren. Zur klinischen Einteilung nach Tumorlokalisation unterscheidet man Karzinome des Pankreaskopfes (72%) und des Pankreasschwanzes (18%).
Beim Pankreaskarzinom unterscheidet man
| WHO/Gipson and Sobin 1978 |
| Adenokarzinom |
| Zystadenokarzinom |
| Azinuszellkarzinom |
| Undifferenziertes Karzinom |
Eine systematische histopathologische Typisierung der Pankreastumoren kann nach Morohoshi erfolgen:
| Ursprung | Entität |
| Duktaler Ursprung: | Duktales Adenokarzinom |
| - Adenosquamöses Karzinom | |
| - Muzinöses Adenokarzinom | |
| - Pleomorphes großzelliges Adenokarzinom | |
| Azinärer Ursprung: | Azinuszellkarzinom |
| Azinäres Zystadenokarzinom | |
| Pankreatoblastom | |
| Unbestimmter Ursprung: | Solid-zystischer Tumor |
| Kleinzelliges Karzinom |
Pathogenese, Ätiologie
Exogene Noxen: Nikotinabusus; "westliche" Nahrungsgewohnheiten; kontrovers: Kaffee- und Alkoholkonsum
Endogene Noxen: Diabetes mellitus
Präkanzerosen: chronische Pankreatitis? Magenresektion?
Beim Diabetiker ist das Pankreaskarzinom 3 x häufiger als in der Normalbevölkerung. 14-38 % der Patienten haben Gallensteine (Bell 1957). Langzeituntersuchungen nach distalen Magenresektionen zeigen, das resezierte Patienten ab 20 Jahre nach der Operation häufiger als die Normalbevölkerung an Pankreaskarzinomen versterben (Caygill).
Epidemiologie
- Prävalenz bei Männern das vierthäufigste, bei Frauen das fünfthäufigste Karzinom. Das "lifelong risk", am Karzinom zu erkranken, beträgt etwa 1:65 (1.54%) beim Mann und 1:67 (1.50%) bei der Frau (www.cancer.org)
- Altersgipfel selten vor dem 45. Lebensjahr; Inzidenz steigt mit Alter (Gipfel bei 60-80 Jahren)
- Geschlecht Männer > Frauen
- Geographie in industrialisierten Regionen häufiger, höchste Inzidenz Neuseeland und Hawaii
Spontanverlauf
ungünstig; ca. 5 Monate Lebenserwartung bei alleinigen Palliativmaßnahmen
Metastasierung
| Leber | 66 % |
| Lymphknoten | 22 % |
| Lunge | 10 % |
TNM Klassifikation des exokrinen Pankreaskarzinoms (2010 7. Auflage)
| TNM | Befund | Ergänzungen |
| Tis | Carcinoma in situ | |
| T1 | Tumor begrenzt auf Pankreas und <= 2 cm | |
| T2 | Tumor begrenzt auf Pankreas > 2 cm | |
| T3 | Tumor überschreitet die Grenzen des Pankreas, aber invadiert nicht den tr. coeliacus oder die a. mesenterica | |
| T 4 | Tumor überschreitet die Grenzen des Pankreas, und invadiert den tr. coeliacus oder die a. mesenterica | |
| N0 | Keine regionären Lymphknoten befallen | Lymphadenektomie von 10 oder mehr regionären LK, sonst NX |
| N1 | Regionäre Lymphknotenmetastasen | |
| M0 | Keine Fernmetastasen | |
| M1 | Fernmetastasen |
Stadieneinteilung des exokrinen Pankreaskarzinoms (2010, gilt nicht für periampulläre Karzinome)
| Stadium 0 | Tis | N0 | M0 |
| Stadium Ia | T1 | N0 | M0 |
| Stadium Ib | T2 | N0 | M0 |
| Stadium IIa | T3 | N0 | M0 |
| Stadium IIb | T1,2,3 | N1 | M0 |
| Stadium III | T4 | jedes N | M0 |
| Stadium IV | jedes T | jedes N | M1 |
TNM Klassifikation des periampullären Pankreaskarzinoms (2010 7. Auflage)
| TNM | Befund | Ergänzungen |
| Tis | Carcinoma in situ | |
| T1 | Tumor begrenzt auf die Ampulla Vateri oder den Sphinkter Oddi | |
| T2 | Einwachsen in die Wand des Duodenums | |
| T3 | Pankreasinfiltration | |
| T4 | Einwachsen in peripankreatisches Bindegewebe oder Nachbarorgane | |
| N0 | Keine regionalen Lymphknoten befallen | Lymphadenektomie von 10 oder mehr regionären LK, sonst NX |
| N1 | Regionale Lymphknotenmetastasen | |
| M0 | Keine Fernmetastasen | |
| M1 | Fernmetastasen |
Stadieneinteilung des periampullären Karzinoms (2010)
| Stadium Ia | T1 | N0 | M0 |
| Stadium Ib | T2 | N0 | M0 |
| Stadium IIa | T3 | N0 | M0 |
| Stadium IIb | T1,2,3 | N1 | M0 |
| Stadium III | T4 | jedes N | M0 |
| Stadium IV | jedes T | jedes N | M1 |
Prästationäre Massnahmen (Hausarzt):
Basis-OP-Vorbereitung
Oberbauchsonogramm
Obligate Diagnostik
Generell: Die Gewinnung einer Histologie ist nur bei Ausschluß des Patienten für resektive Maßnahmen (palliative laparoskopische Gastroenterostomie, Inoperabilität) dringlich. Bei resektabel erscheinenden Pankreaskarzinomen muß die Histologie nicht erzwungen werden (wenn Punktion, dann transduodenal sinnvoller als trankutan).
- Computertomographie des Abdomens
- Thoraxübersicht
- Sonographie
- ERCP
- Tumormarker: CA19-9, CEA, CA50, CA195, CA242 und CA72-4
- Risikoprofil: Basisdiagnostik + Kreatininclearance, Aminopyrintest
 Abbildung: ERCP (mit double duct sign) bei Pankreaskopfkarzinom (Quelle: MRI)
Abbildung: ERCP (mit double duct sign) bei Pankreaskopfkarzinom (Quelle: MRI)
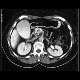 Abbildung: CT Abdomen (mit Raumforderung im Pankreaskopf) bei Pankreaskopfkarzinom (Quelle: MRI)
Abbildung: CT Abdomen (mit Raumforderung im Pankreaskopf) bei Pankreaskopfkarzinom (Quelle: MRI)
Avi Video: siehe auch Videoclip Sonographie: gestaute intrahepatische Gallengänge
Fakultative Diagnostik
- Laparoskopie mit Inspektion der Bursa omentalis und Lymphknoten-PE aus dem Ligamentum hepatoduodenale. Endosonographie
- MDP (Magenausgangsstenose ? Ggf. Gastroenterostomieindikation)
- Angiographie
Therapievorgehen [Chirurgie]
Aufklärung
Magenteilentfernung (Whipple), Darmresektionen, Anastomoseninsuffizienz, postoperativer Diabetes, Pankreasinsuffizienz, Splenektomie, Blutung, Fremdblut, Hepatitis, AIDS, Rezidiv, Reoperation, Intensivpflege, Eigenblut nicht sinnvoll, Lagerungsschaden, bei Komplikation Behandlung auf Intensivstation, Sepsis, Nachbeatmung, bei Langzeitbeatmung Luftröhrenschnitt, Tod
Vorbereitung
Legen eines zentralen Venenkatheters. Abführen mit 1/2-1 Portion Senna z.B. [X-Prep] und 3-4 Flaschen PEG, z.B. [Golytely], wie zum Koloneingriff (wegen mögl. Kolonresektionen).
Operationsverfahren
Die chirurgische Therapie stellt bei Ausschlus von Fernmetastasen die einzige kurative Therapiechance dar.
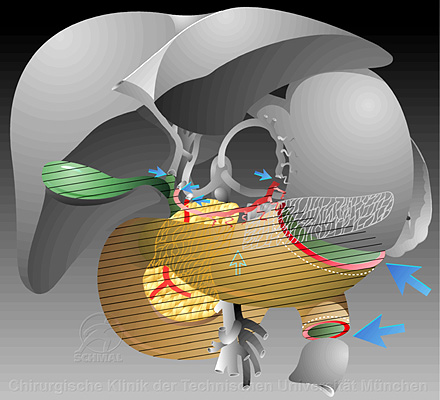
Standardtherapie: Partielle Duodenopankreatektomie (Op nach Whipple), hier mit Resektionsausmaß von Magen und Duodenum
Palliativmaßnahme: Gastroenterostomie oder biliodigestive Anastomose bei inoperablen Karzinomen.
Rekonstruktion:
Standardrekonstruktion in 2-Schlingentechnik mit End-zu-End Pankreatikojejunostomie, End-zu-Seit Hepatiko-Jejunostomie und antekolischer, anisoperistaltischer Gastroenterostomie (abführende Schlinge an kleiner Kurvatur) mit Braunscher Fußpunktanastomose. Der Pankreasblindverschluß wird nicht empfohlen.
Kriterien der Irresektabilität:
Falls eine R0-Resektion nicht erreicht werden kann, sind resektive Maßnahmen sinnlos. Verdacht auf Irresektabilität besteht bei dem angiographischen Nachweis des Befalls der V. mesenterica superior bzw. des Pfortadersystems. Neuerdings sind jedoch R0-Resektionen mit Resektion und Rekonstruktion dieser Venen möglich. Klare Grenzen für resektive Verfahren sind derzeit die Infiltration der a. mesenterica superior oder des Truncus coeliacus. Diese Befunde können häufig erst intraoperativ erhoben werden.
Nachbehandlung
Engmaschige Blutzuckerkontrollen. Totale parenterale Ernährung. Ggf. Insulinperfusor beginnend mit 2 IE pro Stunde. Robinsondrainagen (vor allem die an der Pankreatikojejunostomie gelegene) auf Fistelsekret überprüfen (ggf. Amylase, Lipase bestimmen lassen). Unter Studienbedingungen: Sandostatin (Somatostatin s.c.) zur Prävention von Pankreasfisteln. Bei Splenektomie: Patienten über die erfolgte Splenektomie aufklären. Pneumokokkenimpfung.
Komplikationsrangliste
| Typ | Auftreten (p.o. Tag) | Prävention; Behandlung |
| Blutzuckerentgleisung | 1-2 | engmaschige Blutzuckerkontrollen, ggf. Insulinperfusor |
| Wundheilungsstörung | 3-5 | Verbandskontrollen; |
| Pankreasfistel | 5-7 | Kontrollsono; bei Fieber: CT; ggf. CT-gezielte Punktion |
| Thromboembolische Komplikation |
3 - 7 | Thromboseprophylaxe und Mobilisation des Patienten |
1. postoperativer Tag: Schluckweise Tee, Magensonde ex, dann schrittweise Kostaufbau.
Bei Traversomodifikation: 1. Tag Magensonde ex und schluckweise Tee, dann Kostaufbau
Keine Routine-Kontrolle der Anastomosen erforderlich. Ernährungsberatung. Pankreasfermentsubstitution erforderlich (z.B. Kreon forte 3x2 o. 3x1 Kps, Btl. zu den Hauptmahlzeiten).
Therapieschemen [Onkologie]
Palliative Therapie
Simultane Radio/Chemotherapie via systemischen Port: bei inoperablen Pankreaskarzinomen
Primäre Chemotherapie: Wirkung nicht belegt.
Neoadjuvante Therapie
nur in Studien. Bei primär nicht resektablen Tumoren. Z.b. Kombinierte Radio/Chemotherapie.
Adjuvante Therapie
Indikation: Nach R0 Resektion (ab T3 N1)
Kombinierte Radio/Chemotherapie [Radiatio (hyperfraktioniert) mit 40 Gy (2 Wo, Pause, 2 Wo) + 300 mg/m2 5FU kontinuierlich über Port]
Additive Therapie
Indikation: Bei lokal fortgeschrittenem, nicht resektablem Primärtumor ohne Fernmetastasen
Kombinierte Radio/Chemotherapie (40 Gy split course, an den ersten 3 Tagen 500 mg/m2 5FU (kein Port)
Palliative Maßnahmen
Jejunocath, Gastroenterostomie (ggf. laparoskopisch), Stenteinlage zur Sicherung des Galleabflusses, biliodigestive Anastomose, Plexus-coeliacus-Blockade mit 20 ml 80-90 % Alkohol (CT-gezielt)
Anhaltspunkte zur Prognose
unbehandelt: infaust, nur wenige Monate Überleben ab Diagnose.
resezierte Patienten: 5-Jahresüberlebensquote von nur 5-8 %; mittlere Überlebenszeiten von 15-18 Monate (Papillenkarzinom: 18% 6JÜZ).
Prognostische Faktoren: R-Status nach chirurgischer Therapie, T-Stadium, N-Stadium, Tumorlokalisation, Tumordifferenzierung.