Kolonkarzinom
Klinische Einteilung
Die Einteilung des Kolonkarzinoms erfolgt primär nach seiner Lokalisation.
Von allen kolorektalen Karzinomen finden sich 50 % im Rektum, 30 % der restlichen im Kolon aszendens, 15 % im Kolon transversum und 45 % im Sigma. Morphologisch handelt es sich überwiegend um Adenokarzinome.
Die folgenden Typen werden unterschieden:
- Adenokarzinom
- Adenokarzinom mit Schleimbildung
- muzinöses Adenokarzinom (> 50% Schleimbildung)
- Siegelringzellkarzinom
- undifferenziertes Karzinom
- adenosquamöses Karzinom
- kleinzelliges Karzinom
Hereditäre nicht-polypoide Kolonkarziniome (HNPCC)
Bei ca. 10 % der Karzinompatienten besteht ein sog. HNPCC, d.h. eine genetische Disposition zur Entwicklung eines Kolonkarzinomes. Ursächlich sind Mikrosatelliteninstabilitäten als Ausdruck von nicht funktiontüchtigen Reparaturgenen für die Prädisposition verantwortlich. Charakteristisch sind:
- frühes Alter (Median 40 Jahre) bei Karzinomentstehung
- Lokalisation (70 % der Karzinome befinden sich proximal der linken Flexur)
- Multiplizität der Karzinome (in > 50 % synchrone und metachrone Kolonkarzinome, oder Karzinome des Endometrium, Ovar, Magen, Dünndarm, Nieren)
HNPCC-Genträger entwickeln in > 80 % im Laufe des Lebens einen Tumor. Dies gilt vermindert auch für extrakolische Neoplasien wie Endometrium-, Ovarial-, Magen- und Dünndarmkarzinome sowie Urothelkarzinome des Nierenbeckens und Harnleiters.
Nach aktuellen S3-Leitlinien besteht bei HNPCC Patienten keine gesicherte Indikation für eine prophylaktische Chirurgie i.S. einer subtotalen Kolonresektion.
HNPCC-Risikopersonen ist ab dem 18. Lebensjahr eine genetische Beratung zu empfehlen. Sobald die krankheitsverursachende Mutation in der betreffenden Familie bekannt ist, sollte diese bei den Risikopersonen untersucht werden.
Zur Risikoreduktion eines kolorektalen Karzinoms ist eine hohe Ballaststoffaufnahme wichtig und rotes bzw. verarbeitetes Fleisch sollte nicht täglich verzehrt werden. Obst und Gemüse und eine Limitierung des Alkoholkonsums werden hingegen empfohlen. Mit der Darmkrebsvorsorge für die asymptomatische Bevölkerung sollte ab dem Alter von 50 Jahren begonnen werden. Die komplette Koloskopie besitzt die höchste Sensitivität und Spezifität und sollte daher als Standardverfahren empfohlen werden. Bei unauffälligem Befund Wiederholung der Koloskopie nach 10 Jahren. In einem solchen Setting sind Stuhltest-Screeningverfahren nicht erforderlich. Weder die CT-Kolonografie noch die MRT-Kolonografie können derzeit außerhalb von Studien für das Screening in der asymptomatischen Bevölkerung empfohlen werden.
Neuere Erkenntnisse sprechen dafür, dass die langfristige Einnahme von Aminosalizylate (5-ASA) die Häufigkeit des Auftretens von Kolonkarzinomen verringern kann. Hierbei empfehlen wir eine individuelle Beratung beim Spezialisten.
Pathogenese, Ätiologie
Exogene Noxen:
Ernährung (low fibre diet, rotes Fleisch, Cholesterin, hoher Fettkonsum). Obst und Gemüse: wahrscheinlich protektiver Effekt !
Endogene Noxen:
- Genetische Prädisposition (Verwandtschaft mit Karzinomträger: 3 x erhöhtes Risiko)
- Lynchsyndrom I (Hereditary Nonpolyposis Kolorectal Carcinoma) Autosomale Dominanz; early age of onset; Lokalisation vor allem im proximalen Kolon; Multizentrische Karzinome
- Lynchsyndrom II (Hereditary Site-Specific Nonpolyposis Kolorectal Carcinoma) Wie oben, aber zusätzlich Endometrium-, Ovarial-, Mamma-, Magen-, Dünndarm-, Urogenitaltraktkarzinom
- Z.n. Cholezystektomie ?
- HNPCC
Präkanzerosen und Risikokrankheiten
- Polypen, insbesondere villöse Adenome (Größe über 2 cm: in 50 % karzinomatös), Karzinomprophylaxe durch Polypabtragung ist gesichert !
- Familiäre Polypose. Patienten mit FAP entwickeln nahezu ausnahmslos ein kolorektales Karzinom. Patienten mit klassischer FAP sollten prophylaktisch - wann immer möglich kontinenzerhaltend - proktokolektomiert werden,wenn vertretbar erst nach Abschluss der Pubertät.Nach einer Operation ist eine Pouchoskopie jährlich, bei Patienten mit erhaltenem Rektumstumpf eine Rektoskopie alle 4 Monate erforderlich.
- Auch bei der attenuierter familiären adenomatösen Polyposis (AAPC) besteht ein stark erhöhtes Karzinomrisiko.
- andere seltene Adenomatosen mit extrakolischen Fehlbildungen (Peutz-Jeghers-Syndrom [+Gonadentumoren], Gardner-Syndrom [+ Desmoide, Osteome, Fibrome und Epidermoidzysten], Turcot-Syndrom [+Hirntumoren]);
- Colitis ulzerosa (Risiko bei Pankolitis 15 x erhöht). Es wird bei gestellter Diagnose eine jährliche Vorsorgeendoskopie empfohlen.
- Morbus Crohn (?)
Epidemiologie
Inzidenz: Das "lifetime risk", an einem Kolonkarzinom zu erkranken, liegt bei Männern bei 1:21 (4.7%) und bei Frauen bei 1:23 (4.4%) . Die Sterblichkeit an Kolonkarzinom nimmt stetig ab und die Therapieergebnisse verbessern sich ständig.
In den Vereinigten Staaten gibt es inzwischen > 1 Million Patienten, die von der Erkrankung geheilt werden konnten (www.cancer.org).
Altersgipfel: 50 - 70
Geschlecht: Männer > Frauen
Geographie: Industrienationen, Populationen mit westlichen Diätgewohnheiten
TNM-Klassifikation (2010, 7.Auflage)
| TNM | Beschreibung | Ergänzungen |
| Tis | Carcinoma in situ | bei Tumorzellen in der Basalmembran der Drüsen oder in der Lamina propria, ohne Ausbreitung durch die Muscularis mucosae |
| T1 | Tumor infiltriert Submucosa | |
| T2 | Tumor infiltriert Muscularis propria | |
| T3 | Subserosa oder nicht peritoneal überzogenes perikolisches oder perirektales Gewebe | |
| T4a | Perforation des viszeralen Peritoneums | |
| T4b | Infiltration angrenzender Organe | |
| N0 | keine regionären Lymphknotenmetastasen | Regionäre Lymphadenektomie und Untersuchung von 12 oder mehr Lymphknoten. |
| N1a | Metastasen 1 regionären Lymphknoten | |
| N1b | LK-Metastasen in 2-3 regionären LK | |
| N1c | Tumorknötchen bzw Satelliten im umlieg. Fettgew. ohne reg. Lk-Met. | |
| N2a | Metastasen in 4-6 regionären Lymphknoten | |
| N2b | Metastasen in > 7 regionären Lymphknoten | |
| M0 | Keine Fernmetastasen | |
| M1a | Metastasen beschränkt auf 1 Organ | |
| M1b | Metastasen in > 1 Organ / im Peritoneum |
Stadieneinteilung (UICC 2012)
| Stadium I | T1,2 | N0 | M0 |
| Stadium IIa | T3 | N0 | M0 |
| Stadium IIb | T4a | N0 | M0 |
| Stadium IIc | T4b | N0 | M0 |
| Stadium III | jedes T | N1,N2 | M0 |
| Stadium IIIa | T1 N2a; T1/2 N1a | M0 | |
| Stadium IIIb | T1/2 N2b; T2/3 N2a; T3/4a N1 | M0 | |
| Stadium IIIc | T4b N1/2; T3/4b N2b; T4a N2a M0 | M0 | |
| Stadium IVa | jedes T | jedes N | M1a |
| Stadium IVb | jedes T | jedes N | M1b |
Prästationäre Maßnahmen (Hausarzt):
Basis-OP-Vorbereitung
Obligate Diagnostik
- digital-rektale Untersuchung
- Rö-Thorax
- Sonographie
- CT Abdomen/Becken
- komplette Koloskopie. Falls Überwindung einer Tumorstenose nicht möglich, muss die komplette Koloskopie bei der ersten Nachsorgeuntersuchung nachgeholt werden !
- Rektoskopie.
- Tumormarker: CEA
Risikoprofil: Basisdiagnostik
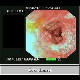 Abbildung: Endoskopie: Kolon-Transversum-Karzinom. (Quelle: MRI)
Abbildung: Endoskopie: Kolon-Transversum-Karzinom. (Quelle: MRI)
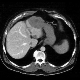 Abbildung: Lebermetastasen eines Kolonkarzinoms im linken Leberlappen (Quelle: MRI)
Abbildung: Lebermetastasen eines Kolonkarzinoms im linken Leberlappen (Quelle: MRI)
Fakultative Diagnostik
nicht definiert
Therapievorgehen [Chirurgie]
Aufklärung
Dickdarmteilentfernung, Ureterverletzung, Verletzung anderer benachbarter Strukturen und Organe, Harnleiterfistel, Anastomoseninsuffizienz, künstlicher Ausgang (vorübergehend oder auf Dauer), Operationserweiterung, Infekt, Wundheilungsstörung, Blutung, Fremdblut, Eigenblutspende nicht sinnvoll, Hepatitis, AIDS, Tumorrezidiv, Lagerungsschaden, intraportaler Katheter, Chemotherapie, ggf. systemische Port-Implantation, bei Komplikation Behandlung auf Intensivstation, Sepsis, Nachbeatmung, bei Langzeitbeatmung Luftröhrenschnitt
|
Vorbereitung (fast track oder ERAS)
|
Vorbereitung (old fashioned)
- Zentraler Venenkatheter
- Darmvorbereitung: 75 ml X-Prep, 2000 - 4000 ml Golitely (bei subtotaler Stenose langsame Spülung über 2-3 Tage bei flüssiger Kost)
in jedem Fall:
- Enthaarung am Bauch und ggf. perineal (bei linksseitigen Resektionen
- Ggf. Anzeichnen der Stomalokalisation durch Stoma-Schwester
Operationsverfahren
Behandlungskonzept:
- Standardverfahren ist die radikale R0-Resektion mit systematischer Entfernung des Lymphabflussgebietes en-bloc. Bei Tumoren an den Grenzzonen (siehe unten) erweiterte radikale Resektion.
- Strikte Vermeidung von Inzisionen in Tumorgewebe und Einrissen im Tumor (ggf. im OP-Bericht dokumentieren). Bei Kontakt mit Nachbarorganen multiviszerale Resektionen.
- Mitentfernung von Fernmetastasen (Leber, Ovar), soweit hierdurch eine R0-Resektion erreichbar ist, je nach Größe des notwendigen Eingriffs synchron oder metachron.
Resektionsausmaß (radikale Lymphadenektomie)
Karzinome der rechten und linken Flexur müssen erweitert rechts- oder linkshemikolektomiert werden, da in 30% Lymphknotenbefall der LK-Gruppe der A. colica media vorliegt!
Bei einer subtotalen Kolektomie wird das Kolon ascendens, - transversum und - descendens entfernt. Die Rekonstruktion erfolgt in der Regel durch eine Ileo-Sigmoidostomie.
Nachbehandlung
- Parenterale Ernährung: nicht zwingend erforderlich
- ab 1. Tag aufbauende enterale Belastung und Reduktion der parenteralen Ernährung.
- Thromboseprophylaxe mit gewichtsadaptiertem niedermolekularem Heparin s.c. nach Standard
- keine Magensonde
- Drainagenentfernung am 2.-3.. Tag
- Keine Antibiotika postop. aus Routine (nur bei spezieller Indikation)
- Fremdblut vermeiden (Prognoseverschlechterung)
- Keine Routine-Kontrolle der Anastomose.
Hinweis: Sämtliche OP-Verfahren können auch laparoskopisch angeboten werden. Die abschliessende Bewertung der Vorteile und Langzeitergebnisse der Verfahren steht noch aus. Bitte lassen Sie sich lokal beraten. Bedenken Sie, dass Sie nur einmal optimal und onkologisch adäquat operiert werden können. Experimente sind in keinem Fall angebracht und im Zweifel ist den offenen Standardverfahren der Vorzug zu geben.
Therapievorgehen (Innere)
Während einer Endoskopie aufgefundene Polypen sollen abgetragen und histologisch nach WHO-Kriterien untersucht werden.
S3-Leitlinie: In Hinblick auf weitere therapeutische Konsequenzen bei komplett entfernten pT1-Karzinomen soll eine zusammenfassende Klassifikation in „Low-risk" (G1, G 2 und keine Lymphgefäßeinbrüche [L0]) oder „High-risk" (G3, G 4, und/oder Lymphgefäßeinbrüche [L1]) erfolgen.Ergibt die histologische Untersuchung eines endoskopisch R 0-entfernten Polypen ein pT1-Karzinom, soll auf eine onkologische Nachresektion verzichtet werden, wenn es sich um eine Low-Risk-Situation bei histologisch karzinomfreier Polypenbasis (R0) handelt. In der High-Risk-Situation ist die radikale chirurgische Behandlung erforderlich, auch wenn die Läsion komplett entfernt wurde.
Therapievorgehen (Onkologie)
Die Entscheidung über ein multimodales therapeutisches Vorgehen fällt beim Kolonkarzinom im Wesentlichen erst nach der Operation, d.h. nach Vorliegen der Resektathistologie und des intraoperativen Befundes.
NeoadjuvanteTherapie:
T4-Tumoren des Zökum/Aszendens und des Deszendens mit Infiltration der seitlichen Bauchdecken.
- Präoperative Radiochemotherapie mit kontinuierlich 5-FU und 40 Gy, IORT oder postoperative Bestrahlung mit 20 Gy.
Adjuvante Therapie:
Bei Patienten mit R0-reseziertem Karzinom im Stadium III ist eine systemische adjuvante Chemotherapie indiziert (z. B. FOLFOX4: Folinsure (FS) (200 mg/m2 als 2-h-Infusion, Tag 1 und 2) plus 5-FU (400 mg/m2 als Bolus, danach 600 mg/m2 als 22-h-Infusion; Tag 1 und 2) in Kombination mit Oxaliplatin (85 mg/m2 als 2-h-Infusion; Tag 1), Wiederholung Tag 15. 1 Zyklus umfasst 2 Wochen, insgesamt 12 Zyklen)
Additive Therapie:
Indikation: bei belassenem Tumorrest und/oder synchronen oder metachronen Metastasen
Stadium II und III und IV (R1/2) : Chemotherapie
M1: Resektable Lungenmetastasen sollten reseziert werden. Lebermetastasen sollten von einem in der Metatsasenchirurgie erfahrenen Chirurgen beurteilt und, wenn möglich, reseziert werden (5-J-Überleben von bis zu 40%). Eine neoadjuvante Therapie der Metastasen kann diskutiert werden, ebenso eine adjuvante CTX.
Irresektabilität:
Eine systemische Chemotherapie ist in den meisten Fällen indiziert. Bitte lassen Sie sich individuell beraten.
Anhaltspunkte zur Prognose
5-Jahres Überlebensraten:
Stadium I 98-100%
Stadium II 75-80%
Stadium III 59-66%
Stadium IV 12-20%
Lokalrezidiv Rate: 5,9% (eigenes Krankengut) - 15%
Prognose Faktoren: R-Status; UICC-Stadium; (p)N-Status; (p)Grading; Tumoreröffnung (erhöhte Lokalrezidivrate)? DNA-Ploidie;
Nachsorge: Klinische Untersuchung, Abdomensono, CEA-Bestimmung, Koloskopie. Die Koloskopie erkennt Lokalrezidive oder Zweittumoren. Alle Patienten sollten prä- oder innerhalb von 6 Monaten postoperativ (bei initialer Tumorstenose) eine komplette Koloskopie erhalten. Eine Koloskopie ist nach 3 Jahren und anschließend alle 5 Jahre erforderlich, um metachrone Karzinome oder Polypen zu entdecken.
Siehe auch:
S3 Leitlinie Kolonkarzinom August 2014